
文章插图
化学biu一biu,让你的化学biu起来~大家好,我是小天老师,今天将给大家讲讲元素周期律和半径大小的表 。元素周期律是高考考察的重要内容,学习元素周期律有利于我们掌握陌生物质的性质,本套讲义知识点讲解较为全面,适合查缺补漏和自学,需要必修二全套知识讲义的也可以私信小天老师,打印出来,学习效果更佳~
今天的知识要点有:1 元素周期律 2 半径大小的比较,最后通过几个题目巩固加深本讲知识点,一定要做完再看解析哦,如果有不清楚的地方,欢迎与小天老师交流 。

文章插图
要点一、元素周期律
1.元素周期律
(1)内容:
元素的性质随着原子序数的递增而呈周期性的变化 。这一规律叫做元素周期律 。元素性质的周期性变化是由元素原子结构的周期性变化所决定的 。
(2)具体表现
①原子半径:
同周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子半径递减;
同主族中,从上到下,随着原子序数的递增,元素原子半径递增 。
②化合价:
同周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;
从IVA族开始,最低负化合价递增(从-4价到-1价),第一周期除外,金属元素一般无负化合价 。
元素最高价的绝对值与最低价的绝对值的和为8。
③元素的金属性和非金属性:
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;
同一主族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减 。
2.1—18号元素的有关知识

文章插图
3.同周期、同主族元素性质的变化规律(0族除外)

文章插图
表格内容比较全面,实际上我们可以通过一幅图,两句口诀来理解

文章插图
口诀:
金失还水碱离氧
含义:金属性就是失电子能力,单质的还原性,与水反应的剧烈程度,最高价氧化物水化物的碱性、离子的氧化性
非金得氧氢稳酸
含义:非金属性就是得电子能力、单质的氧化性、氢化物的稳定性,最高价氧化物水化物的酸性
4.实验探究第三周期元素的金属性、非金属性的递变规律
(1)钠、镁与水的反应
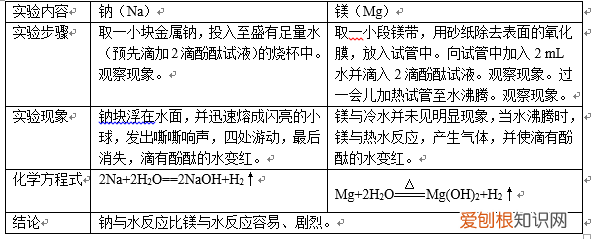
文章插图
(2)镁、铝与盐酸反应
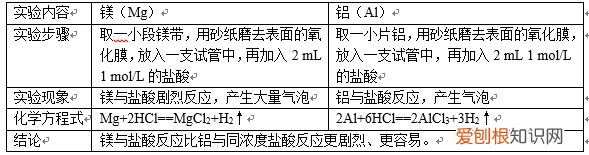
文章插图
(3)钠、镁、铝的最高价氧化物对应水化物的碱性强弱为:
NaOH(强碱)>Mg(OH)2(中强碱)>Al(OH)3(两性氢氧化物)
我们可利用金属单质与水(或酸)反应的难易程度;或者金属元素最高价氧化物对应的水化物的碱性强弱比较金属元素的金属性 。所以Na、Mg、Al的金属性强弱为:Na>Mg>Al 。
(4)我们可利用非金属单质与氢气化合的难易程度;或者非金属元素的最高价氧化物对应水化物的酸性强弱来判断非金属元素的非金属性强弱 。
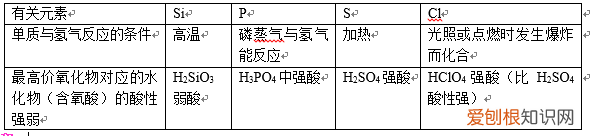
文章插图
要点诠释:
①按照核电荷数递增顺序,单质与氢气化合越来越容易;
推荐阅读
- 硅水凝胶美瞳有年抛 硅水凝胶美瞳有没有年抛的呢
- 木槿花叶子发黄怎么办 木槿花叶子发黄解决
- 种植沙田柚的注意事项 种植沙田柚的注意事项有哪些
- 鳄鱼恤皮包如何辨别真伪,如何鉴别真假皮包包 如何鉴别真假皮
- 塑胶地板有哪些优点 塑胶地板有什么优点
- 华为手机ldn-al20是什么型号 ldnal20是什么型号
- 陌上花开可缓缓归矣下一句是什么
- 蓬莱松盆景怎么养殖 蓬莱松盆景的养殖方法
- 胶水弄地板砖怎么清洗 胶水弄地板砖如何清洗


